https://www.titech.ac.jp/news/2024/069681
https://www.titech.ac.jp/news/2024/069681
要点
- 5員環を含む光学活性3次元化合物を与える高選択的[2+2+1]付加環化反応を開発
- 開発した反応により、約50種類の創薬候補化合物を精密合成
- 5員環構築反応のメカニズムを実験と計算化学の組み合わせにより解明
概要
東京工業大学 物質理工学院 応用化学系の柴原開人大学院生(現:旭化成株式会社)、榧木啓人助教、山城魁里大学院生、永島佑貴助教(現:東京大学)、藤井航平大学院生(現:中外製薬株式会社)、田中健教授の研究グループは、異なる3種類の不飽和化合物[用語1]を室温で混ぜるだけで単一の5員環化合物[用語2]を与える高選択的な[2+2+1]付加環化反応を開発した。
アルキン[用語3]やアルケン[用語4]のような2π成分3分子による触媒的な[2+2+2]付加環化反応は、多置換の6員環化合物[用語5]を高い原子効率にて一段階で合成できる有用な手法である。一方、2π成分のうち1分子が1炭素のみ環化反応に関与すれば、6員環ではなく5員環化合物の合成が可能となる。しかし、触媒的な分子間[2+2+1]付加環化反応の報告例は極めて少なく、エナンチオ選択的[用語6]あるいは3種の異なる2π成分による反応はこれまで報告されていなかった。
研究グループは、触媒として光学活性[用語7]なカチオン性ロジウム錯体[用語8]、基質として架橋構造をもつ環状アルケンと異なる2種類のアルキンを用いることで、6員環化合物を生成することなく単一の光学活性5員環化合物のみを与える高選択的な不斉[2+2+1]付加環化反応を開発した。また、実験と密度汎関数法[用語9]を用いた計算化学解析により、その反応メカニズムを解明した。
研究成果は、英国の科学雑誌「Nature Synthesis」への掲載に先立ち、オンライン版(7月17日付)に掲載された。
背景
多成分反応とは、3種類以上の原料分子を一つの化学反応で結合させ、複数の分子が連結した分子を構築する反応である。原料分子の組合せを変えるだけで、1段階にて膨大な数の有機分子を網羅的に合成できるため、医農薬・機能性材料における新規候補化合物の探索において有用な反応である。一般的な3成分反応では、役割の異なる原料分子(求核剤、求電子剤、不飽和化合物など)を3種類用いることで、選択的に単一の生成物が得られる(図1A)。
[2+2+2]付加環化反応は3成分反応の一つであり、アルキンやアルケンのような2π成分をもつ分子が3つ連結することで、1分子の6員環化合物(2+2+2 = 6)を合成される、原子効率に優れた手法である。研究グループでは、これまでにカチオン性ロジウム触媒を用いたさまざまな高選択的な[2+2+2]付加環化反応を報告してきた。この研究において、基質の配位[用語10]力と構造の精密設計が、高い選択性実現のために重要であるという知見を蓄積してきた。そして、これまで用いられていなかったシス体のエナミド[用語11]を用いることで、エナミド分子中の窒素原子と酸素原子による強固な配位と立体構造により、電子不足内部アルキン[用語12]と電子豊富末端アルキン[用語13]との3成分不斉[2+2+2]付加環化反応が高選択的に進行し、含窒素6員環化合物が単一生成物として得られることを報告した(図1B)。この反応では、統計学的に想定される300種類以上の6員環生成物の中から1種類のみが選択的に得られた。
一方、1つの2π成分を1炭素ユニットとして反応させることができれば、6員環ではなく5員環化合物(2+2+1 = 5)の合成が可能となる。しかし、触媒的な分子間[2+2+1]付加環化反応の報告例は極めて少数であり、エナンチオ選択的あるいは3種の異なる2π成分による反応はこれまで報告されていなかった。
上記の背景のもと、研究グループは、シス体のエナミドに代えて環状アルケン[用語14]を用いることで5員環化合物の合成について検討した。
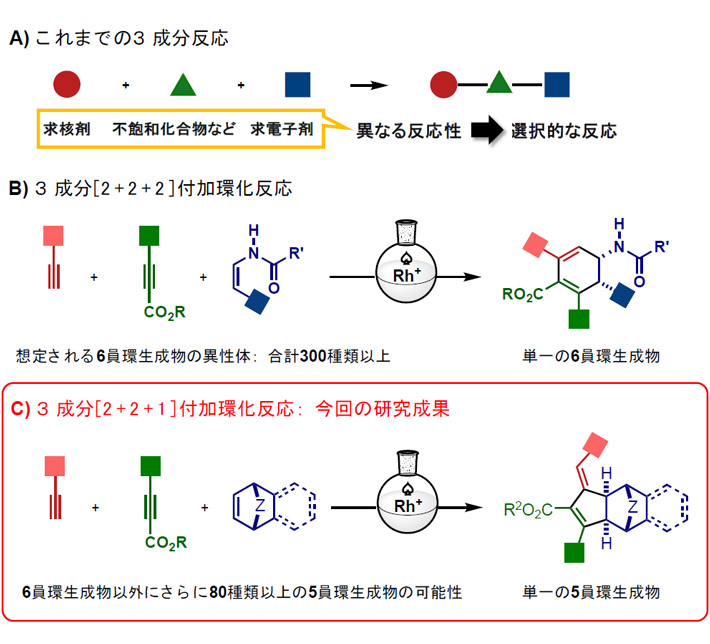
図1. これまでの3成分反応と今回の研究成果
研究成果
本研究では、架橋構造をもつ環状アルケンであるノルボルネン誘導体と、異なる2種類のアルキン(電子不足内部アルキンと電子豊富末端アルキン)を基質として用い、光学活性カチオン性ロジウム錯体触媒存在下において反応させた。実験操作は極めて簡便であり、3種類の基質をほぼ1:1:1で混合し、室温でカチオン性ロジウム触媒の溶液に加えるだけで高選択的に反応が進行する。得られた5員環を含む光学活性3次元化合物の一部は、単結晶X線構造解析により分子構造を決定した。
結果として、高選択的な不斉[2+2+1]付加環化反応が進行することを見出した(図1C)。この反応では、3種類の2π成分がすべて相互に反応し得ることが報告されているため、6員環生成物に加えて80種類以上の5員環生成物が想定されたが、6員環化合物を生成することなく単一の光学活性5員環化合物のみが得られた。研究グループが今回開発した高選択的な不斉[2+2+1]付加環化反応は、基質の適用範囲が極めて広く、基質の置換基[用語15]を変えるだけで多様な分子群が得られる。すなわち、さまざまな置換基をもつ電子豊富末端アルキンと電子不足内部アルキンが使用可能であり、多様な架橋原子や縮環構造をもつ環状アルケンも使用可能である。本研究では、5員環を含む光学活性3次元化合物を合計49種類合成できた(図2)。
![図2 本研究で開発した不斉[2+2+1]付加環化反応](https://www.titech.ac.jp/news/img/news-35256-p2.jpg)
図2. 本研究で開発した不斉[2+2+1]付加環化反応
得られた5員環を含む光学活性3次元化合物は、生理活性・代謝安定性・細胞膜透過性などの医薬品としての特性向上が期待できることから、創薬候補化合物として注目されている。そこで、二重結合部位の化学変換によって、さらに多様な酸素官能基を有する創薬候補化合物への誘導を検討した (図3)。その結果、分子内の2つの二重結合を足がかりとした、さまざまな変換反応に成功した。そのため、今回開発した触媒反応と変換反応は、創薬候補化合物の探索において極めて実用的な反応であることが確認できた。
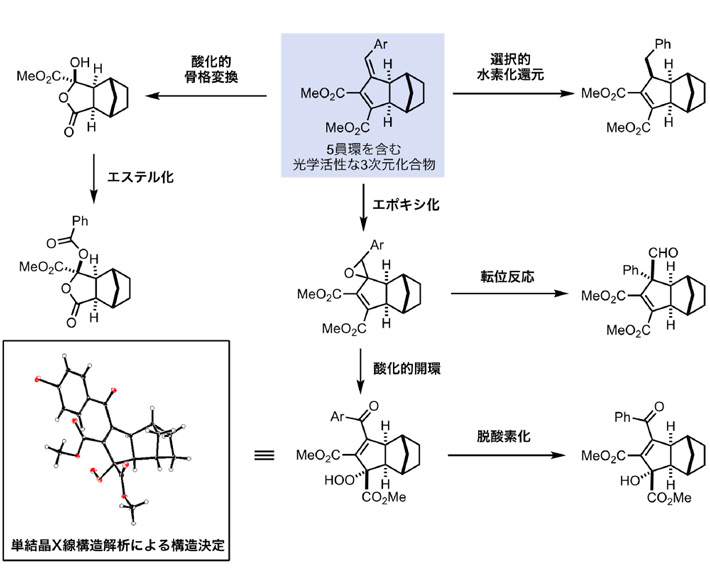
図3. 5員環を含む光学活性3次元化合物の変換
最後に、開発した[2+2+1]付加環化反応の極めて高い選択性を解明するべく、実験による反応メカニズムの解明を行った。その結果、カチオン性ロジウム、ノルボルネン誘導体、電子不足内部アルキンから生成する5員環ロダサイクルと電子豊富末端アルキンが反応してビニリデン錯体が生成し、ビニリデン部位がRh–炭素結合に挿入されることで6員環ロダサイクルとなり、最後に還元的脱離が進行して[2+2+1]付加環化生成物を与えることが示唆された。また、ビニリデン錯体はアルキニル錯体と平衡にあることも示唆された。
このメカニズムの妥当性を確認するために、密度汎関数法による反応メカニズムの検証を行った。その結果、5員環ロダサイクルと電子豊富末端アルキンが反応しビニリデン錯体が生成する遷移状態の活性化エネルギー(13.2 kcal mol–1, TS1)は、室温で進行可能な値であり、5員環ロダサイクルに電子豊富末端アルキンが挿入する遷移状態の活性化エネルギー(20.0 kcal mol–1, TS2)よりも顕著に低いことが明らかになった。さらに、ビニリデン錯体とアルキニル錯体は、プロトンの付加・脱離を介して平衡にあることも裏付けられた。
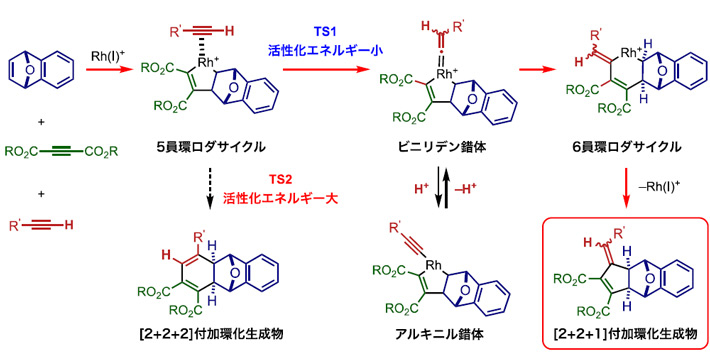
図4. 反応メカニズムの解析。活性化エネルギーを比較するとTS2経路よりTS1経路が小さく、優先的に反応が進行することが考えられる。
社会的インパクト
本研究では、室温にて3種類の基質と触媒を混合するだけで、5員環を含む多彩な光学活性3次元化合物が簡便かつ高選択的に得られることを明らかにした。また、得られた5員環を含む3次元化合物からは、創薬候補化合物を含む多種多様な類縁化合物も誘導可能であることを実証した。したがって、創薬候補化合物の多様性拡大に大きく貢献できると期待される。
今後の展開
今回の研究では、6員環化合物ではなく5員環化合物のみを選択的に与える高選択的な不斉[2+2+1]付加環化反応の開発に成功した。具体的には、カチオン性ロジウム触媒の存在下、ノルボルネン誘導体、電子不足内部アルキン、電子豊富末端アルキンを反応させることで、末端アルキンが5員環ロダサイクルに挿入することなく選択的にビニリデン錯体が生成することを明らかにした。今後、今回示した基質と触媒設計を指針とすることで、ビニリデン錯体を含むさらなる多様な多成分反応の開発へつながると考えている。
付記
本研究は、日本学術振興会(JSPS)科学研究費補助金(No. JP24H00005、No. JP23K17912、No. JP22H05346)の支援を受けて行われた。
用語説明
[用語1] 不飽和化合物 : 構造の一部に、原子同士が2本以上の結合で結合している部位をもつ化合物。このような結合は不飽和結合といい、さらに別の原子と結合することができる。
[用語2] 5員環化合物 : 5つの原子で構成された環をもつ化合物。
[用語3] アルキン : 炭素―炭素三重結合をもつ化合物であり、不飽和化合物の一種。炭素―炭素三重結合が炭素鎖の末端にあるものを末端アルキンという。
[用語4] アルケン : 炭素―炭素二重結合をもつ化合物であり、不飽和化合物の一種。
[用語5] 6員環化合物 : 6つの原子で構成された環をもつ化合物。
[用語6] エナンチオ選択的 : エナンチオマー(互いに鏡像関係にある立体異性体)を識別すること。
[用語7] 光学活性 : キラル分子において、一方のエナンチオマーに偏っている状態。または、そのような溶液に偏光を通した際に、偏光面を右または左に回転させる性質。
[用語8] カチオン性ロジウム錯体 : 金属元素であるロジウムからなる錯体のうち、錯体全体で正電荷をもち、触媒として機能する。触媒とは、化学反応の反応速度を速めたり、特異的な反応を進行させたりする物質であり、反応の前後で性質が変化せず、その構造を保っている。
[用語9] 密度汎関数法 : エネルギーなどの物性を電子密度から計算することが可能であるとする密度汎関数理論を用いる計算手法。
[用語10] 配位 : 原子から金属へ2電子供与することで結合すること。
[用語11] エナミド : アミド結合(-NCHO-)をもちつつ、窒素原子に炭素―炭素二重結合が結合している化合物。
[用語12] 内部アルキン : 炭素―炭素三重結合の両末端に置換基をもつアルキンのこと。
[用語13] 末端アルキン : 炭素―炭素三重結合の一方の末端のみに置換基をもつアルキンのこと。
[用語14] 環状アルケン : 環状構造を有するアルケンのこと。
[用語15] 置換基 : 有機化合物中の水素原子と置き換えられた原子または原子団のこと。
論文情報
掲載誌 : | Nature Synthesis |
論文タイトル : | Rh-catalyzed enantioselective [2+2+1] cycloaddition reactions using three different 2π-components |
著者 : | Kaito Shibahara, Yoshihito Kayaki,* Kairi Yamashiro, Yuki Nagashima, Kohei Fujii, and Ken Tanaka* |
DOI : |
- プレスリリース 高選択的[2+2+1]付加環化反応の開発に成功 —5員環を含む光学活性3次元化合物を高選択的に合成—
- ホウ素と可視光を用いて2次元分子から高度に縮環した3次元分子を直接合成|東工大ニュース
- 優れた円偏光発光特性を有するらせん状分子の合成に成功|東工大ニュース
- 複数のねじれを持つ芳香族ベルト分子の合成に成功|東工大ニュース
- 光反応を促進するハイブリッド型ロジウム触媒を開発|東工大ニュース
- 2次元有機化合物からホウ素・ケイ素を組み合わせた3次元有機化合物を直接合成|東工大ニュース
- 単一分子を与える究極の[2+2+2]付加環化反応を開発|東工大ニュース
- ベルト構造を有する環状分子の精密合成法を開発|東工大ニュース
- 光を利用した「ロジウムアート錯体」の発生に成功|東工大ニュース
- 光を利用した「有機スズジラジカル」の発生に成功|東工大ニュース
- 2023年度「東工大挑戦的研究賞」10人を表彰 うち3人には末松特別賞を授与|東工大ニュース
- 田中健 Ken Tanaka|研究者検索システム 東京工業大学STARサーチ
- 榧木啓人 Yoshihito Kayaki|研究者検索システム 東京工業大学STARサーチ
- 田中健研究室
- 田中健研究室|物質理工学院 研究室検索サイト
- 物質理工学院 応用化学系
- 研究成果一覧
お問い合わせ先
東京工業大学 物質理工学院 応用化学系
教授 田中健
Email tanaka.k.cg@m.titech.ac.jp
Tel 03-5734-2120
東京工業大学 物質理工学院 応用化学系
助教 榧木啓人
Email kayaki.y.ab@m.titech.ac.jp
Tel 03-5734-2881
取材申し込み先
東京工業大学 総務部 広報課
Email media@jim.titech.ac.jp
Tel 03-5734-2975 / Fax 03-5734-3661

0 件のコメント:
コメントを投稿