がん治療・再発予防
クルクミン点滴
 クルクミンの生物活性
クルクミンの生物活性①抗酸化活性1),2)
体内で活性酸素によって惹起される酸化ストレスを軽減しカラダを守る効果を「抗酸化作用」と呼びます。細胞一つ一つに悪影響を与える体内で増加している活性酸素を除去していくことが、老化や、がん、生活習慣病などの予防に繋がると考えられています。
②抗炎症活性3),4),5)
ホスホリパーゼA2、リポキシゲナーゼ、シクロオキシゲナーゼ(COX-2)、ロイコトリエン、トロンボキサン、プロスタグランジン等の炎症の原因となっている様々なサイトカインや分子の働きを抑制、阻止する作用を有していることが培養細胞や動物試験において科学的に分かってきています。
③グルタチオン合成促進6),7)
グルタチオンは細胞性抗酸化酵素の一つで細胞の酸化ストレス制御に重要な役割を果たしています。in vitro研究においてクルクミンが細胞におけるグルタチオン濃度を上昇させ抗酸化作用を持つ可能性が示唆されています。
④癌細胞アポトーシス誘導、腫瘍浸潤、血新生抑制作用8)-12)
各種癌細胞を用いたin vitro研究においてクルクミンが細胞周期の停止やアポトーシスを誘導することが報告されており、そのメカニズムについては細胞シグナル伝達経路に対する抑制などが考えられています。また、クルクミンが腫瘍浸潤のファクターとなる「マトリックスメタロプロテイナーゼ(細胞外基質分解酵素)」の活性を抑制することや腫瘍の成長促進や転移を促す「血管新生」の抑制効果を持つことが報告されています。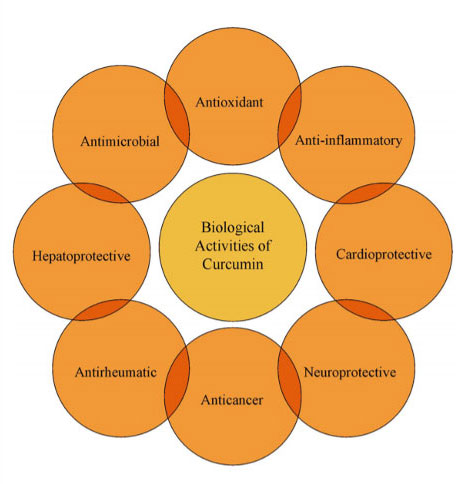

クルクミンの生物学的活性(Front Pharmacol. 2020 Sep 15;11:01021より引用)
癌治療におけるクルクミン点滴療法13)-19)
クルクミンの癌治療における可能性については現段階においてはin vivo、in vitro研究が多くを占めますが、近年は人を対象とした臨床研究が多く進んでおりクルクミンの持つ抗酸化作用により標準治療(化学療法・放射線療法)の副作用軽減に繋がる可能性や免疫寛容を軽減し抗腫瘍免疫を高める可能性が注目されており様々な報告が出てきています。
クルクミンは腸管からの吸収率が低く、バイオアベイラビリティ(生体利用率)の低い物質で体内での半減期も短いためその有効性を高めるため様々な投与形態の研究、開発が進んでいます。クルクミンの点滴製剤はすでに欧米で用いられており、それを用いた臨床試験もすでに実施されています。抗癌剤治療(パクリタキセル)を受ける進行乳癌患者さんを対象としたランダム化比較試験においてクルクミン点滴を併用することの安全性と有効性が報告されています。また、転移性大腸癌の患者さんを対象としたphase-Ⅱaのランダム化比較試験においても化学療法に加えクルクミン投与を併用した群において良好な臨床転帰が報告されています。
放射線治療における皮膚障害や倦怠感などの副作用軽減効果についての報告も複数あり、その有効性が臨床試験において報告されています。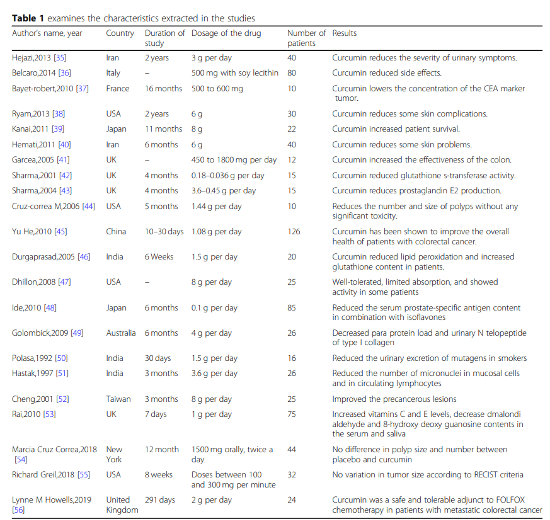

参考文献19)より引用
光感受性物質としてのクルクミン20)-28)
クルクミンの癌治療における可能性については現段階においてはin vivo、in vitro研究が多くを占めますが、近年は人を対象とした臨床研究が多く進んでおりクルクミンの持つ抗酸化作用により標準治療(化学療法・放射線療法)の副作用軽減に繋がる可能性や免疫寛容を軽減し抗腫瘍免疫を高める可能性が注目されており様々な報告が出てきています。
クルクミンは腸管からの吸収率が低く、バイオアベイラビリティ(生体利用率)の低い物質で体内での半減期も短いためその有効性を高めるため様々な投与形態の研究、開発が進んでいます。クルクミンの点滴製剤はすでに欧米で用いられており、それを用いた臨床試験もすでに実施されています。抗癌剤治療(パクリタキセル)を受ける進行乳癌患者さんを対象としたランダム化比較試験においてクルクミン点滴を併用することの安全性と有効性が報告されています。また、転移性大腸癌の患者さんを対象としたphase-Ⅱaのランダム化比較試験においても化学療法に加えクルクミン投与を併用した群において良好な臨床転帰が報告されています。
放射線治療における皮膚障害や倦怠感などの副作用軽減効果についての報告も複数あり、その有効性が臨床試験において報告されています。
エイジングケアとしてのクルクミン29)-31)
クルクミンの持つ強い「抗酸化作用」、「抗炎症作用」によって幅広い分野において素晴らしい効果を発揮する可能性が高いと考えられます。クルクミンはアーユルベーダ医療において古来より用いられてきている天然成分であり悪性腫瘍(癌)、アルツハイマー病、膝関節症や関節リウマチ、動脈硬化性疾患や生活習慣病、慢性腎臓病など様々な疾患に対する治療への可能性を秘めています。また、クルクミンは高い抗酸化作用と抗炎症作用の両方を兼ね備えているため美容目的としてシミやくすみ、色素沈着を軽減してくれることも期待ができます。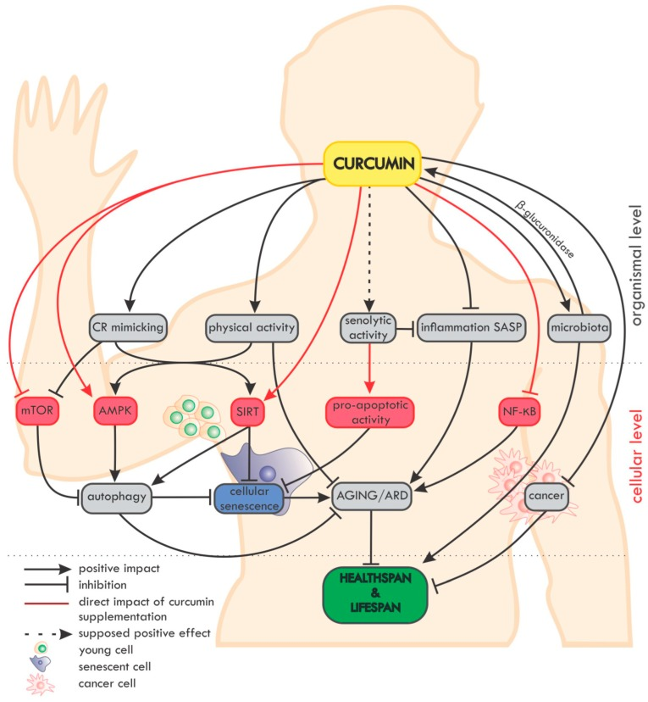

参考文献29),30)から引用
29)https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6429134/pdf/ijms-20-01239.pdf
30)https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6017430/pdf/molecules-23-00835.pdf
治療内容
当クリニックでは欧米において既に使用されているクルクミン点滴製剤をドイツより輸入し使用しております。患者様の病状や治療目的、採血データなど総合的に判断したうえで投与量を決定し、点滴投与をさせていただいております。治療目的により異なりますが週1回~2回を目安とし、まずは2~3か月ご継続いただくことをお勧めしております。クルクミン点滴治療をご希望の患者様は一度、カウンセリングをお受けいただき適応判断を含めましてご相談していただくことをお勧めしております。
リスク・副作用
クルクミン自体には毒性はありません。
以下の副作用は、点滴に含まれる添加物が原因で生じることがあります。
アレルギー反応、アナフィラキシーショック
含有するアルコールによる肝酵素値の上昇
腎臓からグルクロニドとしてのみ排出されるために、クレアチニン値が異常に上昇している場合は注意が必要です。
さらに、稀に起こる事例として、頭痛、吐き気、複視、そして根拠のない強い高揚感が報告されています。
クルクミン点滴の適応について
クルクミン点滴の適応につきましてはカウンセリングを通して患者様の既往歴や採血データ等を総合的に判断したうえで決定させていただいております。
治療の流れ(当院での治療は通院してお受けいただいております)
STEP-1 カウンセリング・問診
医師が状態を診断し、治療の内容について詳しくご説明致します。
STEP-2 クルクミン点滴
1回60分~120分程度の点滴です。
※点滴量やお身体の状態により点滴時間は異なります
※点滴量、治療頻度や回数については医師とご相談いただいております
STEP-3 治療効果の評価
1セット治療の終了後に、治療効果を評価します。また、検査の結果等参考にその後継続可能な治療を検討致します。
未承認医薬品等であることの明示、入手経路等の明示
本治療に用いるクルクミン点滴ついては、医薬品医療機器等法上の承認を得ていないものです。「医師等の個人輸入」により適法な輸入許可を得ています。日本では、未承認医療機器を、医師の責任において使用することができます。
ほかの国内承認を受けている医薬品等の有無
本治療に使用できる同一の性能を有する他の国内承認医薬品等はありません。
諸外国における安全性等に係る情報の明示
下記、参考文献15参照。
(参考文献)
1. Sreejayan, Rao MN. Nitric oxide scavenging by curcuminoids. J Pharm Pharmacol.1997;49(1):105-107.
2. Sreejayan N, Rao MN. Free radical scavenging activity of curcuminoids. Arzneimittelforschung. 1996;46(2):169-171.
3. Hong J, Bose M, Ju J, et al. Modulation of arachidonic acid metabolism by curcumin and related beta-diketone derivatives: effects on cytosolic phospholipase A(2), cyclooxygenases and 5-lipoxygenase. Carcinogenesis. 2004;25(9):1671-1679.
4. Plummer SM, Holloway KA, Manson MM, et al. Inhibition of cyclo-oxygenase 2 expression in colon cells by the chemopreventive agent curcumin involves inhibition of NF-kappaB activation via the NIK/IKK signalling complex. Oncogene. 1999;18(44):6013-6020.
5. Brouet I, Ohshima H. Curcumin, an anti-tumour promoter and anti-inflammatory agent, inhibits induction of nitric oxide synthase in activated macrophages. Biochem Biophys Res Commun. 1995;206(2):533-540.
6. Dickinson DA, Iles KE, Zhang H, Blank V, Forman HJ. Curcumin alters EpRE and AP-1 binding complexes and elevates glutamate-cysteine ligase gene expression. Faseb J. 2003;17(3):473-475.
7. Zheng S, Yumei F, Chen A. De novo synthesis of glutathione is a prerequisite for curcumin to inhibit hepatic stellate cell (HSC) activation. Free Radic Biol Med. 2007;43(3):444-453.
8. Kunnumakkara AB, Anand P, Aggarwal BB. Curcumin inhibits proliferation, invasion, angiogenesis and metastasis of different cancers through interaction with multiple cell signaling proteins. Cancer Lett. 2008;269(2):199-225.ttan G, Kumar KB, Guruvayoorappan C, Kuttan R. Antitumor, anti-invasion, and antimetastatic effects of curcumin. Adv Exp Med Biol. 2007;595:173-184.
10. Moos PJ, Edes K, Mullally JE, Fitzpatrick FA. Curcumin impairs tumor suppressor p53 function in colon cancer cells. Carcinogenesis. 2004;25(9):1611-1617.
11. Bhandarkar SS, Arbiser JL. Curcumin as an inhibitor of angiogenesis. Adv Exp Med Biol. 2007;595:185-195.
12. Hong JH, Ahn KS, Bae E, Jeon SS, Choi HY. The effects of curcumin on the invasiveness of prostate cancer in vitro and in vivo. Prostate Cancer Prostatic Dis. 2006;9(2):147-152.
13. Ryan JL, Heckler CE, Ling M, Katz A, Williams JP, Pentland AP, et al. Curcumin for radiation dermatitis: a randomized, double-blind, placebo-controlled clinical trial of thirty breast cancer patients. Radiat Res. 2013;180(1):34–43.
14. Hemati S, Saeedi A. Clinical evaluation of Oral curcumin in prevention of acute dermatitis in breast cancer radiotherapy. J Isfahan Medical School. 2011;29(152):1129–36.
15. Lynne M Howells, Chinenye O O Iwuji, Glen R B Irving, et al. Curcumin Combined with FOLFOX Chemotherapy Is Safe and Tolerable in Patients with Metastatic Colorectal Cancer in a Randomized Phase IIa Trial. J Nutr. 2019;149(7):1133-1139
16. Tatul Saghatelyan, Armen Tananyan, Naira Janoyan, et al. Efficacy and safety of curcumin in combination with paclitaxel in patients with advanced, metastatic breast cancer: A comparative, randomized, double-blind, placebo-controlled clinical trial. Phytomedicine. 2020;70:153218
17. Claudia Ferri, Kirsten West, Karla Otero, et al. Effectiveness of Curcumin for Treating Cancer During Chemotherapy. Alternative and Complementary Therapies Volume: 24 Issue 1: February 1, 2018
18. Bee Ling Tan, Mohd Esa Norhaizan. Curcumin Combination Chemotherapy: The Implication and Efficacy in Cancer. Molecules. 2019 10;24(14):2527
19. Kamran Mansouri, Shna Rasoulpoor, Alireza Daneshkhah, et al: Clinical effects of curcumin in enhancing cancer therapy: A systematic review. BMC Cancer. 2020 24;20(1):791.
20. Dujic J, Kippenberger S, Ramirez-Bosca A, Diaz-Alperi J, Bereiter-Hahn J, Kaufmann R, et al. Curcumin in combination with visible light inhibits tumor growth in a xenograft tumor model. International journal of cancer 2009;124(6):1422–8.
21. Koon H, Leung AW, Yue KK, Mak NK. Photodynamic effect of curcumin on NPC/CNE2 cells. Journal of environmental pathology, toxicology and oncology 2006;25(1–2).
22. Patrizia Agostinis, Kristian Berg, Keith A Cengel, et al. Photodynamic therapy of cancer: an update. CA Cancer J Clin 2011;61(4):250-81.
23. Behzad Mansoori, Ali Mohammadi, Mohammad Amin Doustvandi, et al. Photodynamic therapy for cancer: role of natural products. Photodiagnosis Photodyn Ther. 2019 June ; 26: 395–404.
24. Ancély Ferreira dos Santos, Daria Raquel Queiroz de Almeida, et al. Photodynamic therapy in cancer treatment - an update review. J Cancer Metastasis Treat 2019;5:25
25. Mukerjee A, Sørensen TJ, Ranjan AP, et al. Spectroscopic Properties of Curcumin: Orientation of Transition Moments. J Phys Chem B (2010) 114(39):12679–84
26. K. T. Kazantzis, K. Koutsonikoli, B. Mavroidi, et al. Curcumin derivatives as photosensitizers in photodynamic therapy: photophysical properties and in vitro studies with prostate cancer cells. Photochem Photobiol Sci. 2020 19;19(2):193-206
27. Ali Ashkbar, Fatemeh Rezaei, Farnoosh Attari, et al. Treatment of breast cancer in vivo by dual photodynamic and photothermal approaches with the aid of curcumin photosensitizer and magnetic nanoparticles. Sci Rep. 2020 3;10(1):21206.
28. Kasipandi Muniyandi, Blassan George, Thangaraj Parimelazhagan, et al. Role of Photoactive Phytocompounds in Photodynamic Therapy of Cancer. Molecules 2020 8;25(18):4102
29. Anna Bielak-Zmijewska, Wioleta Grabowska, Agata Ciolko, et al: The Role of Curcumin in the Modulation of Ageing. Int J Mol Sci. 2019; 20(5): 1239.
30. Sathish Sundar Dhilip Kumar, Nicolette Nadene Houreld, Heidi Abrahamse, et al: Therapeutic Potential and Recent Advances of Curcumin in the Treatment of Aging-Associated Diseases. Molecules. 2018 5;23(4):835
31. Javad Sharifi-Rad, Youssef El Rayess, Alain Abi Rizk, et al: Turmeric and Its Major Compound Curcumin on Health: Bioactive Effects and Safety Profiles for Food, Pharmaceutical, Biotechnological and Medicinal Applications. Front Pharmacol. 2020;11:01021
現在がん治療中の方・今後治療予定の方
標準治療を終えられた方・再発予防を図りたい方
がんリスク検査
がん以外の未病検査








0 コメント:
コメントを投稿