https://www.riken.jp/press/2025/20250328_2/index.html
https://www.riken.jp/press/2025/20250328_2/index.html
理化学研究所(理研)生命機能科学研究センター 生体分子動態デザイン研究チームの新津 藍 チームリーダー、開拓研究本部 杉田理論分子科学研究室の杉田 有治 主任研究員、ジョン・ジェウン 専任技師、環境資源科学研究センター 触媒・融合研究グループの袖岡 幹子 グループディレクター、ブリストル大学のデレック・ウルフソン 教授、キングス・カレッジ・ロンドンのマーク・ワレス 教授らの国際共同研究グループは、自然界にはないタンパク質を理論的に設計する独自の手法を用いて、ペプチド[1]を自己組織的に一定の数で集合させ、脂質二重膜[2]にイオンの透過する孔(あな)を形成する人工イオンチャネル[3]の作製に成功しました。
本研究成果は、生物の生命維持に欠かせないイオンチャネルの機能を理解するためのモデルシステムの開発や、任意の分子のみを透過させる人工分子フィルターなど新しい生体分子材料の開発への応用が期待されます。
今回、国際共同研究グループは、計算機を用いた理論設計を基に、集合するペプチドの数を制御して大きさの異なるイオンチャネルを作製しました。また、スーパーコンピュータ「富岳」[4]と理研Hokusai-BigWaterfall[5]を用いた全原子分子動力学シミュレーション[6]と一分子観察[7]を組み合わせ、人工イオンチャネルが動的な構造変化を示すことを明らかにしました。
本研究は、科学雑誌『Journal of the American Chemical Society』(3月28日付:日本時間3月28日)に掲載されました。
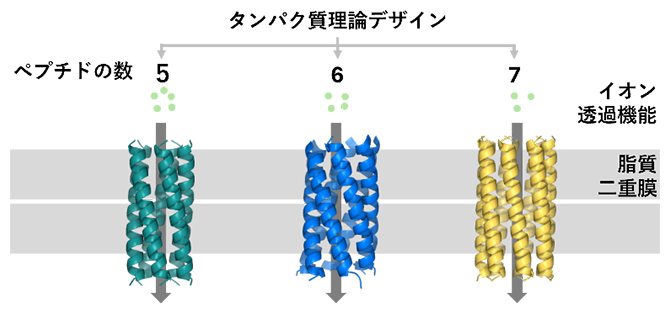
集合するペプチドの数を精密にデザインした人工イオンチャネル
背景
アミノ酸がつながってできるタンパク質は、さまざまな働き(機能)と形(立体構造)を持ち、生命活動を支えています。近年、アミノ酸配列を理論的に設計して人工タンパク質を作る「タンパク質デザイン」の研究が急速に進展し、2024年のノーベル化学賞では「computational protein design」が受賞対象の一つに選ばれました。これまで、望みの立体構造を持った人工タンパク質を得るために、天然に存在するタンパク質のアミノ酸配列を改変するか、もしくはゼロから計算機で予測したアミノ酸配列を用いて、化学反応でアミノ酸をつなげていくペプチド合成や、細胞に備わったタンパク質合成系で人工遺伝子を発現させる方法が確立されています。一方で、タンパク質の機能に欠かせない動的な構造変化も含めてデザインすることや、細胞膜に埋め込まれた状態で働く膜タンパク質[8]を作製することは依然として困難でした。ここで問題となっているのは、アミノ酸配列-立体構造-機能をつなぐ普遍的なルールが未知であるため、どのようにデザインすれば目的の立体構造が得られ、タンパク質を働かせることができるのかを予測できないことです。
膜タンパク質の中でも、膜を貫通する孔を持ち、細胞膜内外のイオンのやり取りを担うイオンチャネルは生物の生命維持に欠かせない分子です。このイオンチャネルの最も単純なタイプは、複数本の同じペプチドが自己集合することで一つのチャネルを形成する、ペプチドイオンチャネルです。これまで、天然に存在するペプチドイオンチャネルを模倣した人工ペプチドのデザインが行われてきましたが、集合するペプチドの数を精密に制御するデザイン方法は確立されていませんでした。今回、国際共同研究グループは独自のアミノ酸配列デザイン法を用いて、ペプチドイオンチャネルのデザインルールの解明に挑みました。
研究手法と成果
ペプチドイオンチャネルの基本構造の一つである「コイルドコイル[9]」は、7個のアミノ酸配列の繰り返しから成るα-ヘリックス[9]ペプチド(以下、ペプチド)が、ねじり合うように集合してできた立体構造です。本研究では、このコイルドコイルを基本として、5本以上のペプチドが集合して中心に孔を持つ筒状の構造となるように計算機上でデザインしました(図1)。ここでは、ウルフソン教授らが以前に開発した水溶性のペプチド集合体のデザイン方法注1)を応用して、膜と相性の良い疎水性アミノ酸[10]を筒の外側に、イオンが通りやすい極性アミノ酸[10]を孔側に配置し、ペプチドの接触面には小さいアミノ酸であるアラニンを用いることで膜貫通イオンチャネルとなるようにしました。全部で144通りのアミノ酸配列から、最も望みの筒形構造を取りやすいと期待される候補を理論スコア(得点)から選び出して、実験用のペプチド合成に進みました。ペプチドの先頭には、プラスの電荷を持つアミノ酸であるリシンを4個導入し、溶解性を高めるとともに膜に対する挿入方向が一定になるようにしました。
化学合成したペプチドの約75%は脂質二重膜環境を模した水溶液中でα-ヘリックス構造を取り、また脂質二重膜の存在下では、このα-ヘリックス構造が85℃まで維持され、デザインした膜貫通部分が安定な構造を取っていることが示されました。さらにペプチドの集合体を解析したところ、5量体で存在することが明らかになりました。
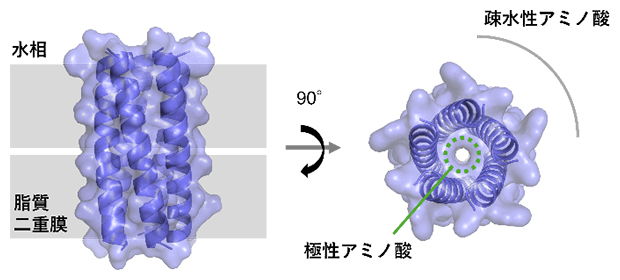
図1 デザインした人工ペプチドイオンチャネル5量体の構造モデル
α-ヘリックス構造を取るペプチドが5本集合してコイルドコイルを形成し、脂質二重膜に貫通して中心にイオンを透過する孔を持つようにデザインした。具体的には、外側に疎水性アミノ酸、内側に極性アミノ酸を配置したペプチドのアミノ酸配列を計算機上で生成した。分析超遠心と呼ばれる実験手法により、ペプチドが5量体で存在することが示された。
次に、この5量体がイオンチャネルとして機能するかを検証する実験を行いました。細胞膜の主成分である脂質二重膜は電気的には絶縁体ですが、膜にイオンチャネルが存在すると、イオンの透過により電気を通します。そこで、平面状の脂質二重膜にペプチドを挿入し、チャネル電流を測定したところ、低い電圧をかけたときは低い導電状態を示しました。その後、電圧を高くすると高い導電状態となり、このとき、チャネルの大きさが切り替わって電流の通りやすさが段階的に変動したことを示すステップ電流値が観察されました。さらに、電圧の強弱に伴い、低導電状態と高導電状態との間で可逆的な変化が起こることも確認されました(図2)。低導電状態のコンダクタンス(89±24pS)は、デザインしたペプチドが5量体としてイオンチャネルを形成したときの理論値(約100~200pS)と矛盾しない値を示しました。
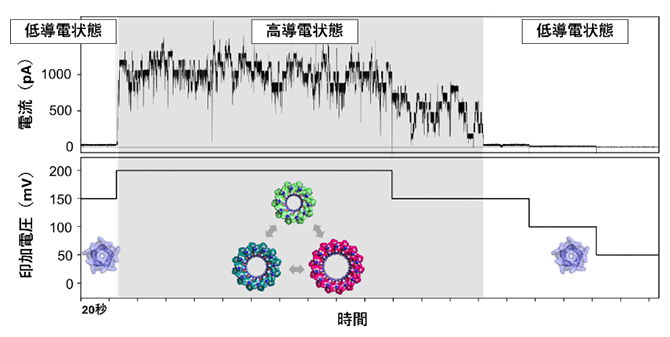
図2 チャネルを通る電流の測定によるイオン透過機能の解析
合成したペプチドを平面脂質二重膜に挿入し、形成されたチャネル一つに流れる電流(一分子チャネル電流)を測定した。脂質二重膜に低い電圧をかけたときには、5量体としてデザインしたときの理論値とよく一致し、安定なチャネルを形成する低導電状態となった。一方、電圧を高くすると、チャネルの大きさが変わることでステップ(階段)状に変動する電流値を示す高導電状態となった。グラフ中のチャネル構造の模式図は、高導電状態でペプチドの集合数が変化している可能性を示す。電流の単位はピコアンペア(pA、1pAは1兆分の1アンペア)。
続いて国際共同研究グループは、この5量体を形成するペプチドのアミノ酸配列を起点として、ペプチド同士の接触面に配置するアミノ酸の大きさを変化させることで、ペプチドが集合する数を制御できることを見いだしました。具体的には、筒の外側に位置する四つの疎水性アミノ酸をイソロイシンから小さなアラニンに置き換えるか、または孔側に位置する四つの極性アミノ酸をセリンから大きなスレオニンに置き換えると、どちらの操作でも5量体から7量体の構造に変化することが確認されました(図3中・右)。さらに、孔側に一つだけある疎水性アミノ酸のシステインを化学修飾してサイズを大きくすることで、5量体から6量体に変更できることも確認しました(図3中・左)。これはアミノ酸の大きさの変化がペプチドの接触面の角度を大きくし、結果として集合数が増えることを示唆しています。これらの結果から、アミノ酸配列とペプチドの集合数を結ぶルールを明らかにしました。
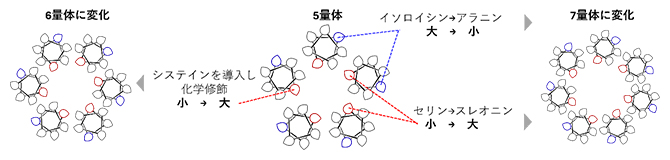
図3 ペプチドの集合数を制御するアミノ酸配列のデザインルール
5量体を形成するペプチドのアミノ酸配列を基本として、赤または青で示した位置のアミノ酸を異なる大きさのアミノ酸に置き換えると、ペプチド同士の接触面の角度が変化し集合する数を制御できることが分かった。システインについては、アミノ酸の置換ではなくアルキル化の化学修飾を行った。アミノ酸配列を変更したペプチドは分析超遠心を用いて、界面活性剤中で集合している数を確認した。
これらの6量体や7量体を形成するペプチドのイオンチャネル機能を調べたところ、5量体と同様の導電状態を示すことが分かりました。特筆すべき点として、高導電状態のコンダクタンス[11](電流の通りやすさ)の値はペプチドのアミノ酸配列を変えても大きな差はなかったものの、低導電状態のコンダクタンス値はペプチドのアミノ酸配列によって、単なる集合数との比例関係とは異なる違いが見られました。具体的には、集合数が多くイオンが通りやすいと予想される7量体ペプチドのコンダクタンス値は小さく、5量体の方が大きな値を示しました。これらの結果と全原子分子動力学(以下、分子動力学)シミュレーションを用いた構造モデリングから、アミノ酸配列のわずかな変更によって孔の形状が変化し、その結果としてイオンチャネルの機能が大きく左右されるという、アミノ酸配列と機能の新たな相関が明らかになりました。
最後に国際共同研究グループは、高導電状態のステップ(階段)状の電流値が観測されるメカニズムを解明するため、全反射蛍光顕微鏡[7]を用いたペプチドイオンチャネルの一分子観察を行いました。ステップ電流は、単一のチャネルの膨張・収縮によるものか、複数のチャネルが膜に形成した結果なのかのいずれかの可能性が考えられます。そこで、イオンチャネルを透過するカルシウムイオン(Ca2+)を蛍光色素によりイメージングしたところ、膜表面の一つの点の蛍光強度がステップ状に変化する様子が観測されました。さらに、このカルシウムイオンの透過点近傍に、合成したペプチドが確かに存在していることも蛍光標識ペプチドの観察から確認できました。これらの結果から、高導電状態は単一のペプチドイオンチャネルであり、膜電位に依存してその直径がステップ状に変化する動的な性質を持つと結論付けられました(図4)。
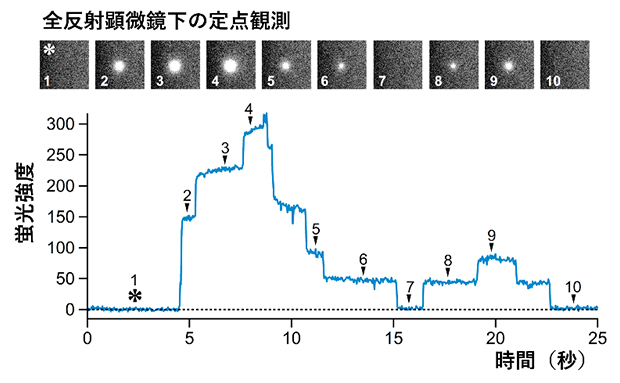
図4 印加電圧存在下でのペプチドイオンチャネルの全反射蛍光顕微鏡観察
脂質二重膜上に形成されたイオンチャネルを透過するカルシウムイオンを蛍光色素(Fluo-8H)により観察した画像(上)と蛍光強度の時間変化(下)。顕微鏡下の定点においてステップ状の蛍光強度を示したことから、高導電状態では複数のチャネルが形成されるのではなく、単一のチャネルの大きさが動的に変化していることが明らかとなった。「*」は蛍光強度が0である範囲を示す。
このような動的な性質は、天然に存在する抗菌性ペプチドであるアラメチシン[12]でも見られます。アラメチシンのこれまでの研究結果注2)から、チャネルの大きさの変化はペプチドの集合数が増減することで生じると考えられています。そこで国際共同研究グループは、デザインした集合数よりも多い10量体、15量体、20量体のペプチドイオンチャネル構造について、分子動力学シミュレーションを行いました。その結果、膜電位がない場合にはこれらの多量体構造は維持できず、特に10量体はデザインした構造と同様な5~7量体の形成を示しました。対照的に、実験と同様の膜電位存在下では、イオンチャネルはゆがむものの安定性の向上が見られました。またシミュレーションからは、10量体イオンチャネルのコンダクタンス値は、高導電状態での実験値(1.4ナノジーメンス(nS、1nSは10億分の1ジーメンス))に近い約1.2nSであると推定されました。これらの結果から、今回デザインしたペプチドは低い膜電位では安定な低導電イオンチャネルを形成し、高い電圧下では周囲に存在するペプチドを取り込んで動的で大きなイオンチャネルを形成する可能性が示されました。
- 注1)Thomson, A. R.; Wood, C. W.; Burton, A. J.; Bartlett, G. J.; Sessions, R. B.; Brady, R. L.; Woolfson, D. N. Computational design of water-soluble alpha-helical barrels. Science 2014, 346 (6208), 485-488. DOI: 10.1126/science.1257452.
- 注2)Woolley, G. A. Channel-forming activity of alamethicin: effects of covalent tethering. Chem. Biodivers. 2007, 4 (6), 1323-1337. DOI: 10.1002/cbdv.200790113
今後の期待
今回作製したペプチドイオンチャネルは、膜電位に応答して構造や導電性が変動する性質があります。この特徴は、例えば神経細胞などに存在する膜電位応答イオンチャネルタンパク質の構造と機能を理解するためのモデルシステム開発へと応用できる可能性があります。
本研究で見いだされた人工ペプチドイオンチャネルの構造と機能を制御する基礎となる合理的なデザインルールは、ペプチドのどの部分にどのようなアミノ酸を配置すべきかの重要な手掛かりとなります。一方、今後の課題として、出来上がったイオンチャネルの動的挙動を予測して制御する方法を見つける必要があり、分子動力学シミュレーションや機械学習は有効なアプローチとなるでしょう。さらに、生体分子材料としての将来的な応用展開では、膜の脂質組成や電位、曲面構造といった生理的な条件をデザインに取り入れることで、イオンチャネル機能をさらに拡張できる可能性があります。将来、天然には存在しないような高機能チャネルタンパク質の合成を実現できれば、イオン・分子選択性を持つ分子フィルターとしての溶質ろ過装置や、人工細胞・バクテリアによる有用物質生産システムなどへの応用が期待されます。
補足説明
- 1.ペプチド
ペプチドとタンパク質は、核酸に保存された遺伝情報を基に20種類のアミノ酸をつなぎ合わせることで合成される。一般的に短いもの(50アミノ酸以下)はペプチドと呼ばれ、長いものはタンパク質と呼ばれることが多い。 - 2.脂質二重膜
細胞膜などの生体膜の基本構造。主に、親水基と疎水基を併せ持つリン脂質から成る。水溶液中では、疎水基同士が向かい合って親水基が水分子側に露出するため、二重構造の膜と成る。 - 3.イオンチャネル
膜を貫通する孔を持ち、細胞の内外のイオンの濃度差を調節するために、イオンを濃度勾配に従って透過させる膜タンパク質。イオンを受動的にかつ非常に速く(1秒当たり100万~1億個程度)生体膜を透過させる機能を持ち、神経細胞においては電気信号を生み出し伝える重要な役割を担っている。 - 4.スーパーコンピュータ「富岳」
スーパーコンピュータ「京」の後継機。2020年代に、社会的・科学的課題の解決で日本の成長に貢献し、世界をリードする成果を生み出すことを目的とし、電力性能、計算性能、ユーザーの利便性・使い勝手の良さ、画期的な成果創出、ビッグデータやAIの加速機能の総合力において世界最高レベルのスーパーコンピュータとして2021年3月に共用が開始された。現在「富岳」は日本が目指すSociety5.0を実現するために不可欠なHPCインフラとして活用されている。 - 5.理研Hokusai-BigWaterfall
超並列演算システム、大容量メモリ演算サーバーと、フロントエンドサーバー、2種類のストレージから構成される。理研での科学技術研究などの推進と発展に資する研究のために使われている。 - 6.全原子分子動力学シミュレーション
原子間に働く力を計算し、運動方程式を繰り返し解くことで、分子の動きを追跡する方法。 - 7.一分子観察、全反射蛍光顕微鏡
一分子観察は、蛍光分子1個が出す光を顕微鏡観察することで、分子の挙動を1分子レベルで追跡するイメージング技術。全反射蛍光顕微鏡は、一分子観察技術の一つで、蛍光分子を1分子の精度で検出(1分子イメージング)するための顕微鏡。ガラスと水溶液の界面で励起光を全反射させることで、水溶液中の、界面から100ナノメートル(nm、1nmは10億分の1メートル)程度の高さの領域だけに励起光を閉じ込め、その領域に存在する蛍光分子だけを励起、検出することができる。 - 8.膜タンパク質
受容体やチャネル、膜輸送体など、細胞膜や細胞内小器官の膜の中で働くタンパク質の総称。 - 9.コイルドコイル、α-ヘリックス
タンパク質の立体構造を構成する要素のうち、鎖状につながったアミノ酸がらせん状の形を取る二次構造をα-ヘリックス構造という。同じα-ヘリックス、または異なるα-ヘリックスが2本以上会合し、互いにらせん状に絡み合った構造をコイルドコイルと呼ぶ。 - 10.疎水性アミノ酸、極性アミノ酸
生物が利用する20種類のアミノ酸のうち、水に溶けにくい性質(疎水性)持つものを疎水性アミノ酸、正または負の電荷を持ち水に溶けやすい性質(親水性)を持つものを極性アミノ酸と呼ぶ。 - 11.コンダクタンス
電気抵抗(Ω)の逆数であり、電流の流れやすさを示す。単位はジーメンス(S:siemens)。 - 12.アラメチシン
カビが産生する抗生物質の一種。20アミノ酸残基から成る抗菌ペプチドで、脂質二重膜に入り込むと3~12分子が集合してイオンチャネルを形成する。
国際共同研究グループ
理化学研究所
生命機能科学研究センター 生体分子動態デザイン研究チーム
チームリーダー 新津 藍(ニイツ・アイ)
開拓研究本部 杉田理論分子科学研究室
主任研究員 杉田 有治(スギタ・ユウジ)
専任技師 ジョン・ジェウン(Jung Jaewoon)
環境資源科学研究センター 触媒・融合研究グループ
グループディレクター 袖岡 幹子(ソデオカ・ミキコ)
ブリストル大学(英国)化学科
教授 デレック・ウルフソン(Derek N. Woolfson)
博士課程(研究当時)アリスター・スコット(Alistair J. Scott)
キングス・カレッジ・ロンドン(英国)化学科
教授 マーク・ワレス(Mark I. Wallace)
博士研究員(研究当時)ジェイソン・センゲル(Jason T. Sengel)
グラスゴー大学(英国)
講師 アンドリュー・トムソン(Andrew R. Thomson)
オックスフォード大学(英国)
教授 ヘイガン・ベイレイ(Hagan Bayley)
ラジブ・ガンディーバイオテクノロジ-センター(インド)
ラマリングスワミファカルティフェロー
コジンジャンパラ・マヘンドラン(Kozhinjampara R. Mahendran)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究)で実施し、科学技術振興機構(JST)戦略的創造研究推進事業さきがけ「自在配列膜貫通ペプチド精密設計法の開発と機能開拓(研究代表者:新津藍、JPMJPR22A9)」、日本学術振興会(JSPS)科学研究費助成事業学術変革領域研究(A)「無細胞分子システムで機能する膜貫通タンパク質モジュールの理論設計(研究代表者:新津藍、24H01162)」、文部科学省「富岳」若手課題「人工膜タンパク質理論設計法開発に向けたde novo設計膜ペプチド会合動態の分子動力学計算(課題番号:hp230090)」、「富岳」一般課題「拡張アンサンブル法による生体分子動態の解析(課題番号:hp210107)」などによる助成を受けて行われました。
原論文情報
- Ai Niitsu, Andrew R Thomson, Alistair J Scott, Jason T Sengel, Jaewoon Jung, Kozhinjampara R Mahendran, Mikiko Sodeoka, Hagan Bayley, Yuji Sugita, Derek N Woolfson, and Mark I Wallace, "Rational design principles for de novo α-helical peptide barrels with dynamic conductive channels", Journal of the American Chemical Society, 10.1021/jacs.4c13933
発表者
理化学研究所
生命機能科学研究センター 生体分子動態デザイン研究チーム
チームリーダー 新津 藍(ニイツ・アイ)
開拓研究本部 杉田理論分子科学研究室
主任研究員 杉田 有治(スギタ・ユウジ)
専任技師 ジョン・ジェウン(Jung Jaewoon)
環境資源科学研究センター 触媒・融合研究グループ
グループディレクター 袖岡 幹子(ソデオカ・ミキコ)
ブリストル大学(英国)
教授 デレック・ウルフソン(Derek N. Woolfson)
キングス・カレッジ・ロンドン(英国)
教授 マーク・ワレス(Mark I. Wallace)
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム![]()
科学技術振興機構 広報課
Tel: 03-5214-8404
Email: jstkoho@jst.go.jp








0 コメント:
コメントを投稿